復方君臣佐使配伍保健食品終于開啟備案試點。
2025年9月9日國家市場監督總局聯合國家衛健委和中醫藥管理局發《國家市場監督管理總局辦公廳國家衛生健康委辦公廳國家中醫藥局綜合司關于開展國產復方配伍保健食品備案管理試點工作的通知》。
這意味著,復方保健食品終于不用遵循“注冊制”,通過備案試點即可。

目前我國保健食品備案以單一原料或簡單復配為主,難以體現中醫藥“君臣佐使”的配伍理念,也無法滿足消費者對多功能養生產品的需求。
此次試點是通過規范復方配伍保健食品的備案流程,以“備案制”替代部分“注冊制”,簡化創新產品上市流程,推動備案保健食品行業從“單一原料”向“復方功效協同”升級。
試點以藥食同源物質為復方核心原料,本質是將中醫藥理論與現代保健食品結合,推動“藥食同源”從“傳統食材”向“功能性原料”升級。
通過“原料白名單”、“配方數量限制”、“全周期追溯”等要求,讓藥食同源復方產品“配方邏輯”、“安全依據”更加透明。
01
國產復方配伍保健食品備案試點可選擇的原料名單
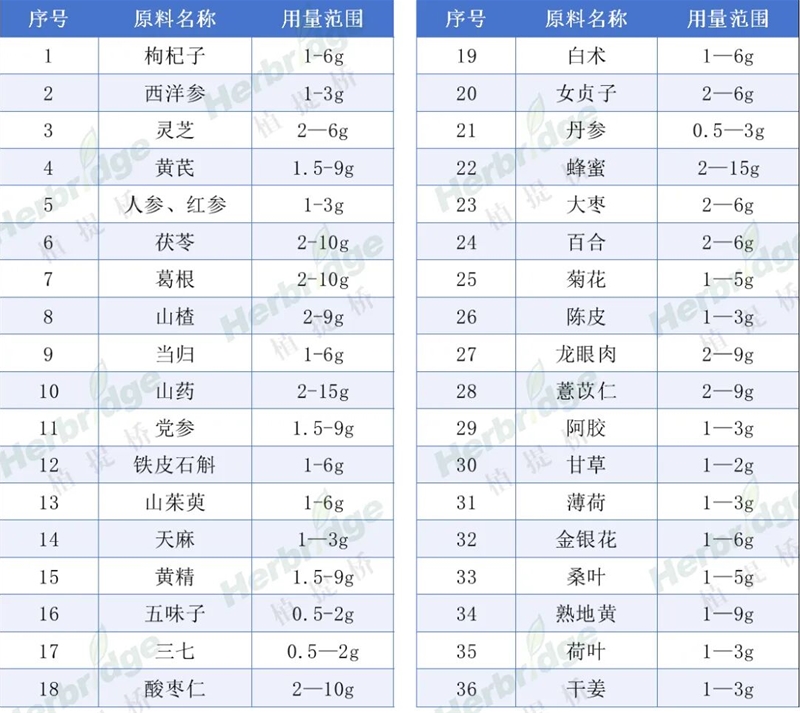
說明:
1)限數量、倡精簡的配方邏輯;備案產品原料數量不超過14個,其中藥食同源之外的原料,不超過4個。
2)適宜人群:
與《允許保健食品聲稱的保健功能目錄非營養素補充劑( 2023年版》中保健功能相對應的人群;
可結合傳統中醫養生理論細化人群描述。
3)不適宜人群:
少年兒童、孕婦、乳母;
結合產品的特點,可細化傳統中醫中禁忌人群的描送。
4)注意事項:西洋參、黨參、丹參不宣與含有藜蘆的中草藥及其制品同用。紅參、人參不宜與含有藜蘆、五靈脂的中草藥及其制品同用。
5)試點產品可選擇的功效及要求
可選擇《允許保健食品聲稱的保健功能目錄非營養素補充劑(2023年版》范圍內的保健功能,以及符合我國保健食品監管定位和傳統中醫養生理論的保健功能。
產品備案時可選擇1-2個保健功能聲稱。對于申報2個保健功能的,還應當提供不同保健功能可同時聲稱的合理性依據。
02
文件其它核心內容盤點
●試點期限:為批復之日起3年;
● 備案人資質要求:相應的研發、生產、檢驗能力;
備案人應當為獲得保健食品注冊證書或者保健食品備案憑證并已轉化實際生產的保健食品生產企業。五年內產品未出現過不合格的情形,且近三年內未受到行政處罰等。
●功效驗證:備案前完成動物實驗、人體試食試驗;按照《保健食品功能檢驗與評價技術指導原則(2023年版)》《保健食品功能檢驗與評價方法(2023年版)》等規定開展功能性評價試驗。
●試點產品備案號:(省)食健備(試)G+4位年代號+2位省級行政區域代碼+6位順序編號,其中順序編號由各省(區、市)自行制定。
●產品銷售與追溯:在本省(區、市)內線下銷售至保質期結束。
●試點流程:
試點申請——技術審查——技術咨詢——試點核準——信息歸集——試點監管——試點取消——試點轉歸。

03
小結
試點對企業的研發、生產、檢驗能力及數據追溯提出明確要求,企業需投入資金用于人才儲備、設備升級、檢測及合規體系建設。
試點備案的核心參與者是那些具備研發實力、合規記錄良好的頭部企業,可依托現有中醫藥研發團隊,結合“君臣佐使”理論開發差異化復方產品;借助試點備案制的便捷性,快速將創新配方轉化為產品,搶占市場先機。
在線咨詢